Editora: Ana Laura Milhazes
Colaboradoras: Ana Carolina Simoneti, Beatriz Cernescu, Gabrielly de Araújo e Sophia Barbosa
Conceito de Tumor[]
É a proliferação celular anormal de células do hospedeiro que perderam a capacidade de responder aos mecanismos de controle normal de crescimento, multiplicando-se assim, de forma descontrolada. Os tumores geralmente são clonais, ou seja, originam-se de uma única célula alterada que foi acumulando mutações (5 a 6 mutações sucessivas são necessárias) até dar origem às células neoplásicas propriamente ditas. O desenvolvimento de uma célula cancerígena é um processo multifásico conduzido por uma série de mutações sucessivas, que progressivamente convertem uma célula normal para um estádio pré-cancerígeno, e posteriormente para o estádio cancerígeno.
Na evolução do câncer de cólon, por exemplo, a células normais do
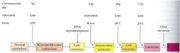
Evolução do câncer de colo de útero Fonte: slides da Profa. Maristela Adamovski
epitélio sofrem diversas alterações, incluindo a inativação de três supressores tumorais (APC, DCC E p53) e a ativação de um oncogene que induz a proliferação celular (K-ras).
O Câncer Como Uma Doença Genética[]
Não existe uma causa única para o câncer, sendo o conjunto de múltiplos fatores como hereditariedade e componentes ambientais (alguns vírus, agentes químicos, irradiações,..) decisivo para o desenvolvimento dos tumores. Em outras palavras, os tumores são entendidos como o resultado de agressões ambientais em um indivíduo geneticamente suscetível.
Carcinogênese Química[]
O principal mecanismo de ação dos carcinógenos químicos é a formação de compostos covalentes com o DNA que aumentam a probabilidade de ocorrência de erros durante a replicação. A carcinogênese se dá em dois estágios:
1. Iniciação: é a transformação celular promovida pela substância cancerígena, tornando-a potencialmente capaz de se multiplicar de maneira autônoma.
2. Promoção: consiste na proliferação das células iniciadas É um processo mais demorado, com propriedade de irritar os tecidos e provocar reações inflamatórias.
Exemplos:
- Aminas aromáticas: presentes nas indústrias de borracha e corantes
- Alcatrão: contém hidrocarbonetos policíclicos
- Nitrosamidas: produzidas por bactérias intestinais (Ex: Helicobacter pylori)
- Agente Alquilantes: encontrados na poluição ambiental e em quimioterápicos como a ciclofosfamida
- Aflatoxina: produzida por fungos nos cereais (prevalente em áreas rurais)
- Azocompostos: presentes nos corantes dos alimentos
Carcinogênese por Radiação[]
Tanto as radiações excitantes (ultravioletas) como as ionizantes (raios-x e raios gama) podem provocar tumores no ser humano. As radiações podem ativar oncogenes e/ou inativar supressores tumorais. Os raios ultravioleta provenientes da luz solar são provavelmente o agente cancerígeno mais atuante na nossa espécie, tendo uma estreita relação com os cânceres de pele.
Carcinogênese Viral[]
Ocorre quando o DNA ou RNA oncogênico viral se integra ao genoma do hospedeiro, resultando na síntese de algumas proteínas (Ex: EBNA-5 produzida pelo vírus Epstein-barr e E6 produzida pelo Papilomavírus Humano 6)que se ligam às proteínas codificadas pelos genes supressores de tumor (Ex: p53, Rb,..), impedindo assim o processo de apoptose.
Os exemplos mais bem documentados são:
- Vírus da Leucemia Humana de Células T (HTLV-1) - causador da leucemia de células T e linfomas
- Vírus da Hepatite B (HBV) - causador do carcinoma hepatocelular
- Papilomavírus Humano (HPV) - causador do câncer de colo uterino
- Vírus Epstein-barr (EBV) - associado ao linfoma de Burkit, carcinoma nasofaríngeo e Doença de Hodkin
Envelhecimento[]
Acredita-se que a idade avançada seja um fator aumente a incidência de câncer devido a uma série de motivos. Durante o processo de envelhecimento ocorre um acúmulo de lesões não corrigidas do DNA, o indivíduo encontra-se exposto por mais tempo a agentes cancerígenos, existe uma maior chance de ocorrer uma mutação crítica e a vigilância imunológica encontra-se reduzida.
Processo de Proliferação Celular[]
De forma bastante resumida existe uma série de acontecimentos a nível
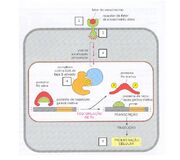
Processo Molecular Fonte: slides da Profa. Maristela Adamovski
molecular envolvidos na proliferação celular. É a alteração de algum desses estágios (de acordo com os números da figura ao lado) que vai desencadear o processo de carcinogênese. Primeiramente uma molécula, que pode ser um fator de crescimento ou um fator de transcrição, é recebido por receptores presentes na membrana celular. Posteriormente, esse reconhecimento vai gerar sinais que atravessarão vias de sinalização intracelular (transdução do sinal) e desencadearão uma cascata de reações químicas envolvendo fosforilações, tendo como resultado, a proliferação celular.
Categoria de Genes Alvo[]
Existem três categorias de genes considerados alvo no processo de carcinogênese. São elas:
Proto-oncogenes:[]
Genes cujos produtos ativam a proliferação celular. Em condições normais são genes ativos e importantes para as células e quando adequadamente regulados não provocam transtornos do crescimento celular. Tornam-se indesejáveis ao sofrer alteração na sua estrutura (mutação) ou quando se encontram hiperexpressados.
Exemplos:
- Fatores de crescimento e proliferação celular - sis
- Receptores de fatores de crescimento - cerbB-2 (relacionado ao câncer de mama)
- Moléculas envolvidas na transdução do sinal - K-ras
- Fatores de transcrição - cmyc, jun e fos
Supressores Tumorais[]
Genes cujos produtos inibem a proliferação. Em caso de ausência ou dano, permiti-se a multiplicação de células com mutações, aumentando assim o potencial de transformação celular.
Exemplo:
- p53 - Localizado no cromossomo 17, esse gene trabalha no sentido de manter o ciclo celular estacionado na fase G1 permitindo o reparo de genes alterados
Genes cujos produtos regulam a apoptose:[]
Por ser essencial para regular a população normal celular de um individuo normal, a apoptose assume grande importância na gênese das neoplasias.
Exemplo:
- bcl2, gene produtor de proteínas que se ligam fortemente às proteínas codificadas por genes supressores do crescimento celular, impedindo-as de induzir a apoptose.
Antígenos Tumorais[]
São proteínas produzidas pelas células tumorais capazes de gerar resposta imune. A investigação laboratorial dos antígenos tumorais tem sido amplamente utilizada tanto no fechamento do diagnóstico quanto na monitorização da evolução da doença. São classificados em dois tipos:
- Antígenos Tumorais Específicos:
Presentes somente em tumores, sendo ainda exclusivos para cada tipo de tumor. Podem ser gerados por mutações de oncogenes, como o gene k-ras (posição 12) no câncer de pâncreas ou por mutações gênicas que codificam proteínas internas (normalmente não expressadas) que se ligam aos MHC de classe 1, como o antígeno MAGE do melanoma.
- Antígenos Tumorais Associados ao Tumor:
Presentes tanto em células normais (em menores concentrações) quanto em tumores. Apesar dessa característica são considerados "marcadores" de tumor. Exemplos:
- a) Antígenos Oncofetais:
- - CEA, associado ao carcinoma colorretal.
- - Alfa fetoproteína, associada a carcinomas hepáticos.
- Obs: os antígenos oncofetais estão presentes durante a vida intrauterina. No entanto, ao nascimento, os genes produtores dessas proteínas devem ser silenciados, caso contrário, são considerados "marcadores" tumorais.
- b) Carboidratos Antigênicos Associados a Tumor:
- - CD5-LT, presente normalmente em linfócitos T, porém quando encontrado na superfície de linfócitos B é indicativo de leucemia linfocítica crônica.
- - Proteínas do Grupo Sanguíneo, quando encontradas no epitélio gástrico, indicando câncer gástrico.
- - CA 125, presente nos casos de endometriose e em níveis mais discrepantes no câncer e ovário.
- c) Antígenos de Diferenciação:
- - CALLA/ CD10, presente nas células progenitoras de linfócitos B, porém quando em níveis muito elevados é indicativo de leucemia linfoblástica.
- d) Antígenos com Produção e Secreção Alteradas:
- - PSA (antígenos prostático específico), associado ao câncer de próstata.
- e) Hiperexpressão de Alguns Genes:
- - erb B3, receptor para fator de crescimento epidérmico com expressão aumentada no câncer de mama.
- - erb B1, receptor para fator de crescimento epidérmico com expressão aumentada no carcinoma de células escamosas do pulmão.
Imunologia dos Tumores[]
As principais células envolvidas são os linfócitos T citotóxicos (LTc), os linfócitos T auxiliares (LTa), as células NK e os macrófagos. Os LTc promovem a destruição direta das células tumorais (através da ação de perforinas e granzimas) mediante a apresentação das suas proteínas alteradas (antígenos) nos HLA's de classe I. Esse combate é mais eficiente em neoplasias associadas aos vírus. Após a atividade do LTC o restante dos antígenos são apresentados pelas células dendríticas em HLA's de classe II aos LTa, que produzem citocinas do tipo I.
Atividade das Citocinas do tipo I[]
- Proliferação de LTc e LTa (IL-2)
- Ativação das células NK (IL-2 e INF-ɣ)
- Ativa LB a produzir anticorpos (principalmente IgG e IgM) contra antígenos específicos, induzindo o combate às células-alvo por citotoxidade dependente de anticorpos (ADCC)
- Ativação dos macrófagos (INF-ɣ e TNF-β) - atividade em estudo
Obs: os anticorpos também podem ativar o sistema complemento, no entanto, só são efetivos no combate aos tumores moles.
As células NK são as principais combatentes dos tumores. Elas atuam na ausência de uma proteína acessória do HLA de classe I. Acredita-se serem capazes de reconhecer o receptor NKR-P1, semelhante a lectina, que teoricamente se ligaria a um resíduo de carboidrato do alvo. As células NK, da mesma forma que os LTc, também promovem a morte direta das células e liberam citocinas como o TNF-α e o INF-ɣ , que ativam fagócitos e recrutam LT.
Os macrófagos, que são ativados pelo INF-ɣ e TNF-β, também exercem diversas funções, dentre elas:
- Funcionam como células apresentadoras de antígenos (APC's) para os LTa.
- Produzem IL-12, que ativa células NK.
- Produzem citocinas pró-inflamatórias como a IL-1 e o TNF-α, responsáveis pela perda de peso, perda de apetite, febre, anemia e mal-estar.
- Produzem fatores quimiotáticos para neutrófilos, linfócitos e monócitos, como a IL-8.
Mecanismos de Escape do Tumor[]
As células tumorais possuem alguns mecanismos que as possibilitam escapar do sistema imune. São eles:
- Ausência de B7 (CD28) - molécula co-estimulatória.
- Ausência de moléculas de adesão - favorecem a metástase.
- Diminuição da atividade dos HLA's de classe I.
- Liberação de TGF-β (citocina regulatória) que inibe a proliferação de LT.
- Apresenta moléculas não adesivas, como a mucina, que "repelem" o sistema imune.
- Impede secreção de IL-12, impedindo a ativação das células NK.
- Produção de prostaglandinas que impedem a atividade de células NK e macrófagos.
- Impedem a maturação das células dendríticas (passagem da forma inativa para a forma ativa) no interior do tumor
Diagnóstico[]
Os tumores precisam ser diagnosticados, estadiados e monitorados durante o tratamento. Diagnóstico é feito por exames histológicos ou citológicos (aspiração ou biópsia), sendo cada vez mais utilizada a investigação dos marcadores tumorais.
Tratamento[]
Atualmente segue-se basicamente quatro linhas de tratamento:
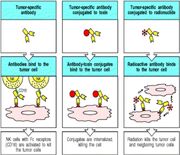
Anticorpos Monoclonais Fonte: slides da Profa. Maristela Adamovski
- Cirurgia
- Radioterapia
- Quimioterapia
- Imunoterapia (anticorpos monoclonais, vacinas e utilização de citocinas)
Dando um maior destaque ao uso de citocinas, podemos citar algumas situações:
- Administração direta de interleucinas, como o INF, para aumentar a atividade das células NK e ativar a expressão dos HLA's de classe I e II pelas células tumorais. Podem trazer efeitos adversos extremos por não se saber ao certo as concentrações ideais a serem usadas
- Ativação das células NK após cultura in vitro com IL-2 e posterior infusão no paciente
- Imunoestimulção não específica induzida por IL-2 para a produção de células efetoras como o LTc e as células NK, embora seja necessário a conjugação com outra terapia
- Proliferação de células dendríticas: essa terapia utiliza citocinas como a IL-4, o TNF-α e o GM-CSF para estimular monócitos a se diferenciarem em células dendríticas, que serão recolocadas no paciente.
Existe ainda a possibilidade de manipulação de sinais co-estimulatórios. É o caso da promoção da hiperexpressão do gene B7 que expressa a molécula B7 feita em células tumorais para gerar a ativação do sinal, e da hiperexpressão de TCR/BCR, que são receptores de linfócito T e B para os HLA's.
Também é realizada a transferência de células tumorais as quais foram adiocionadas o gene que codifica o GM-CSF (fator estimulatório de crescimento de monócitos e granulócitos), que quando reinfundidas no paciente irão secretrar GM-CSF capaz de conduzir a ativação das APC's no hospedeiro, especialmente as células dendríticas.
Referências:[]
1. ROITT, Ivan M.; BROSTOFF Jonathan; MALE David K. Imunologia. BR, SP, Manole Ltda. 1999
2.
3. MILHAZES, Ana Laura. Anotações da aula da Disciplina de Imunologia. UNIVILLE. 18/03/2013