Editora: Thais Yuri Miura
Colaboradoras: Elisa Correia e Laíssa Mara R. Teixeira
Vírus Varicela-zoster[]
O VZV tem semelhanças com o HSV como fato de a latência ser estabelecida nos gânglios sensoriais e doença recorrente; imunidade celular no controle e prevenção da doença grave; lesões bolhosas características. As infecções primárias com VZV causam varicela (catapora), enquanto a reativação do vírus latente causa herpes zoster (“cobreiro”).
Estrutura e replicação[]
Possui o menor gene dos herpesvírus humanos. O VZV estabelece infecção latente nos neurônios, mas diferentemente do HSV, diversos RNAs e proteínas virais específicas podem ser detectados nas células.
Patogênese e imunidade[]
A transmissão se dá através de perdigotos, que resultam na infecção inicial da mucosa respiratória, seguida pela disseminação aos linfonodos regionais. A replicação viral nos pulmões é uma fonte importante de contágio. Os vírus entram na corrente sanguínea e são disseminados por todo o corpo pelos leucócitos mononucleares infectados. Vesículas características contendo vírus da catapora surgem de 14 a 21 dias após a exposição.
O vírus permanece associado a células e é transmitido na interação célula-a-célula, exceto em células epiteliais diferenciadas nos pulmões e queratinócitos de lesões cutâneas, que podem liberar vírus infecciosos. O vírus pode ser reativado quando a imunidade diminui, se replica e é liberado ao longo de toda via neural, o que é chamado herpes zoster.
A latência é estabelecida em múltiplos gânglios sensoriais, sendo os mais comuns o trigêmeo e os gânglios da raiz dorsal. A imunidade celular é essencial para limitar o progresso e provocar a regressão da doença. Uma resposta exagerada em adultos com infecção primária é responsável por causar lesões celulares mais extensas e manifestações mais graves que aquelas vistas em crianças.

Epidemiologia[]
Taxas de infecção maior de 90% em ambiente suscetível. Transmitida via respiratória, mas pode ser transmitida pelo contato direto com vesículas cutâneas. Mais de 90% dos adultos em países desenvolvidos apresentam anticorpo contra VZV. Herpes zoster resulta da reativação do vírus latente.
Síndromes clínicas[]
As doenças primária e recorrente (varicela e zoster) são bem distintas. Nenhuma apresenta risco de vida ao indivíduo normal e saudável, mas pode ter complicações graves em pacientes imunocomprometidos.
- • Infecção primária (varicela ou catapora): em uma criança o período de incubação é de 14 a 16 dias. O 1° surgimento do exantema frequentemente é precedido por sintomas como febre, mal-estar, cefaleia e dor abdominal. O exantema se inicia no couro cabeludo, na face ou no tronco como máculas eritematosas, que evoluem para vesículas contendo vírus com base eritematosa após cerca de 48h. Este tipo de vesícula é a marca característica da varicela. Após 12h, a vesícula se torna pustular e forma crosta, surgindo a lesão crostosa. Lesões novas continuam a aparecer durante um período de até 6 ou 7 dia. A cura ocorre sem formação de cicatrizes.
A infecção primária é mais grave em adultos do que em crianças. A pneumonia por varicela é a mais comum das complicações graves, mas a falência hepática fulminante e a encefalite por varicela também podem ocorrer. A infecção primária de uma gestante pode fazer com que ela contraia a forma adulta da varicela, e pode infectar o feto ou o neonato. A infecção fetal inicial na gestação é incomum, mas pode resultar em múltiplas anomalias do desenvolvimento fetal. A gravidade da doença depende de a mãe ter começado a produzir IgG anti-VZV até o momento do parto.
- • Infecção recorrente (herpes zoster ou “cobreiro”): resulta da reativação do vírus latente, e não de uma nova exposição exógena. A reativação ocorre em 15% dos indivíduos infectados. A característica mais notável do herpes zoster é que a distribuição dos exantemas de lesões vesiculares é em dermátomo e dor forte na área de inervação precede o aparecimento das lesões. Neuralgia pós-herpética pode persistir por meses ou anos, em pacientes com mais de 65 anos que desenvolvem herpes zoster.

onte: Fhttp://blogpediatriaparatodos.blogspot.com.br/2012/10/o-que-e-zona-herpes-zoster.html
Diagnóstico laboratorial[]
Varicela ou zoster não-complicados o diagnóstico é feito em função da aparência clínica e da distribuição típica das lesões. Em pacientes imunocomprometidos, é necessário distinguir a infecção por VZV de outros exantemas similares.
- Culturas de tecido inoculadas com uma amostra de líquido das vesículas mostram alterações citopáticas grosseiras em vários dias;
- Imunofluorescência ou coloração com imunoperoxidase, com anticorpos contra as proteínas virais detectam células individuais infectadas;
- Diagnóstico rápido: reagir células epiteliais raspadas (esfregaço de Tzanck) da base de vesículas com as colorações descritas, ou fazendo hibridização in situ com sondas de DNA específicas para o VZV.
- Sorologia: usados para triagem de pessoas quanto à imunidade contra VZV. Exames sensíveis como imunofluorescência e ELISA devem ser realizados para detectar anticorpos.
Tratamento[]
Em imunocomprometidos, adultos e crianças, o uso de aciclovir, famciclovir e valaciclovir é usado nas infecções por VZV. O aciclovir oral reduz o curso de tempo e a dor aguda do zoster, mas tem pouco ou nenhum efeito sobre a neralgia pós-herpética subsequente. O fanciclovir e o valaciclovir – análogos de base similares ao aciclovir – têm atividade maior contra o VZV.
Prevenção e controle[]
Indivíduos suscetíveis (ex. neonatos, adultos não- imunes e crianças imunocomprometidas que foram expostas ao líquido de lesão da catapora ou zoster) podem ser protegidos pela administração de imunoglobulina contra a varicela zoster (VZIG). A vacina induz proteção a partir de anticorpos e imunidade celular, é um tratamento profilático mesmo após a exposição do indivíduo ao VZV.
Vírus Epstein-Barr (EBV)[]
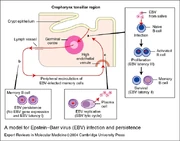
Principal parasita de linfócitos B, causa mononucleose infecciosa com presença de anticorpos heterofilos, apresentando relação causal com linfoma de Burkitt endêmico, doença de Hodgkin e carcinoma nasofaríngeo. O EBV estimula o crescimento e imortaliza as células B.
Estrutura e replicação[]
Apresenta receptor para o componente C3d do sistema complemento. A infecção por EBV pode ter 3 desfechos:
• O EBV pode se replicar em células B ou células epiteliais permissíveis para sua replicação.
• O EBV pode causar a infecção latente de células B na presença de células T competentes.
• O EBV pode estimular e imortalizar as células B.
Nas células epiteliais e nas células B, ocorre a transcrição e tradução da proteína ativadora de transcrição ZEBRA, que ativa os genes precoces imediatos do vírus e o ciclo lítico. As proteínas virais produzidas durante uma infecção produtiva são definidas e agrupadas como antígeno precoce (EA), antígeno de capsídeo viral (VCA) e as glicoproteínas do antígeno de membrana (MA). Durante a infecção não-permissiva, são expressos genes virais como antígenos nucleares de Epstein-Barr (EBNAs) 1, 2, 3A, 3B e 3C, proteínas latentes (LPs), proteínas latentes de membrana (LMPs) 1 e 2. EBNAs e LPs são proteínas de ligação de DNA essenciais para o estabelecimento e manutenção da infecção e imortalização.

Patogênese e imunidade[]
As doenças por EBV resultam de uma resposta imune hiperativa (mononucleose infecciosa) ou da falta de controle imune efetivo (linfoma e tricoleucoplasia).
As proteínas do EBV ativam o crescimento de células B e também impedem sua apoptose. A ativação e proliferação de células B ocorrem e são indicadas pela produção anômala de um anticorpo IgM contra o antígeno de Paul-Bunnell, chamado de anticorpo heterófilo.
Durante a infecção produtiva, se desenvolvem anticorpos contra VCA e MA, e posteriormente contra EA. Depois de controlada a infecção, são produzidos anticorpos contra os antígenos nucelares. As células T são essenciais para limitar a proliferação das células infectadas por EBV e para controlar a doença. Linfocitose, inchaço de órgãos linfoides e astenia estão associados à mononucleose infecciosa e resultam da ativação e proliferação de células T. As células T são vistas como linfócitos atípicos (células de Downey). O EBV pode ser reativado quando a célula B de memória é ativada, podendo ser liberada na saliva.
Epidemiologia[]
O EBV é transmitido pela saliva, “doença do beijo”. Mais de 90% das pessoas infectadas por EBV liberam o vírus por toda a vida, mesmo quando assintomática. Receptores de transplante, pacientes imunossuprimidos estão sob maior risco de apresentar transtornos linforpoliferativos iniciados por EBV.
Síndromes clínicas[]
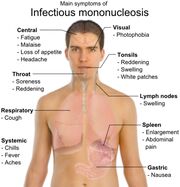
Crianças apresentam a infecção subclínica. Sintomas clássicos da mononucleose infecciosa são linfadenopatia, esplenomegalia e faringite exudativa, associados a febre alta, astenia e hepatoesplenomegalia. Principal queixa é a fadiga. Pode causar complicações neurológicas em imunossuprimidos como meningoencefalite e a síndrome de Guillian-Barré.
O EBV pode apresentar cronicidade, com sintomas como febre baixa, cefaleia e dor de garganta.
Indivíduos com déficit de imunidade podem ter doença proliferativa de células B. Receptores de transplante tem um alto risco de desenvolver doença linfoproliferativa pós-transplante, após a exposição ao vírus ou a reativação de um vírus latente. O linfoma de Burkitt do tipo africano ocorre na mandíbula e face e é endêmico em regiões afetadas pela malária. Linfomas de Hodgkin também podem ser atribuídos ao EBV.
Diagnóstico laboratorial[]
Diagnóstico com base nos sintomas, achado de linfócitos atípicos (indicação precoce de infecção por EBV) e presença de linfocitose, anticorpos heterófilos (indicação de infecção por EBV em adultos) e anticorpos contra antígenos virais.
• PCR, análise de sonda de DNA para pesquisar o genoma viral e identificação por imunoffluorescência são utilizadas para detecção de infecção.
A infecção por EBV é indicada por:
- • Anticorpos IgM contra o VCA
- • Presença de anticorpo para VCA e ausência de anticorpo contra EBNA
Tratamento e prevenção[]
Não há tratamento efetivo ou vacina disponível contra as doenças por EBV.
A infecção promove a imunidade por toda a vida, por isso, a exposição ao vírus na infância é indicado, quando a doença é mais benigna.
Citomegalovírus humano (HCMV) []
Nos EUA, é a causa mais comum de infecções intra-uterinas e de anomalias congênitas. Também representa ameaça séria a pacientes imunodeficientes ou imunossuprimidos.
Estrutura e replicação[]
Ciclo de replicação é mais longo, e as células infectadas são muito aumentadas e mutinucleadas, daí o nome “citomegalo”. O vírion do CMV transporta mRNAs específicos para dentro da célula para facilitar a infecção e só se replica em células humanas (fibroblastos, células epiteliais, macrófagos). O vírus estabelece infecção latente em linfócitos mononucleares, células do estroma da medula óssea e outras células.
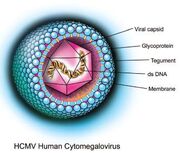
http://trabajosmedicos.blogspot.com.br/2011/08/citomegalovirus.html
Patogênese e imunidade[]
Infecção inicial com HCMV ocorre durante a infância. O CMV estabelece rapidamente infecções persistentes e latentes, em vez de uma extensa infecção lítica. O CMV é disseminado pelo corpo dentro de células infectadas, como linfócitos e leucócitos. O vírus é reativado por imunossupressão e por estimulação alogênica.
O vírus altera a função de linfócitos e leucócitos, e impede a apresentação de antígenos para as células T CD8 citotóxicas e T CD4. Proteína viral também bloqueia o ataque, pelas células NK, de células infectadas por CMV.
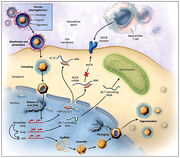
Invasão pelo CMV. Fonte: http://www.saval.cl/cienciaymedicina/progresosmedicos/11428.html
Epidemiologia[]
Infecção em crianças costuma ser assintomática, e elas disseminam vírus durante meses por meio dos líquidos corporais (lágrimas, urina e saliva). As vias congênita, oral e sexual, a transfusão sanguínea e o transplante de tecidos são os principais meios de transmissão de CMV.
o Incidência da infecção por HCMV na população é alta e as infecções recorrentes inaparentes periódicas ocorrem frequentemente.
o O vírus está presente no leite materno e, portanto, os neonatos podem ser infectados por esta via. Também pode atravessar a placenta e infectar o feto in útero. O CMV é a causa viral mais prevalente de doenças congênitas. Recém-nascidos infectados congênita e perinatalmente são importantes reservatórios para o vírus.
o Replicação inicial do vírus nas células epiteliais dos tratos respiratório e gastrointestinal (GI) é seguida pela viremia e infecção de todos os órgãos do corpo. Em casos sintomáticos, o epitélio tubular renal, o fígado e o SNC, além dos tratos respiratório e GI, são mais comumente afetados.
Síndromes clínicas[]
- Indivíduos saudáveis: infecção primaria por HCMV não costuma ser aparente. O CMV é uma doença sexualmente transmissível.
- A infecção primaria de um adulto pode resultar em uma síndrome de mononucleose que é clinicamente idêntica àquela causada pelo vírus Epstein-Barr (EBV). Estima-se que cerca de 8% dos casos de mononucleose infecciosa (MI) sejam causados por HCMV.O que distingue a MI causada por HCMV é a ausência dos anticorpos heterófilos que caracterizam a MI causada pelo EBV.
- Infecções congênitas: HCMV é a infecção viral intra-uterina mais comum. Em mães com infecção primaria por HCMV durante a gestação (portanto ainda não produziram anticorpos contra HCMV), 35 a 50% dos fetos serão infectados, e infectados, e 10% destes serão sintomáticos. A gravidade dos sintomas é maior quando a infecção ocorre durante o 1° trimestre. Lesões variam desde a morte fetal a vários graus de lesão ao fígado, baço, órgãos formadores do sangue e componentes do sistema nervoso (perda de audição, retardo mental).
- Receptores de transplante imunossuprimidos estão em risco por vários fatores:
- HCMV presente no tecido que foi transplantado
- Vírus transportado por leucócitos nas transfusões sanguíneas
- Reativação de seus próprios vírus latentes endógenos
- A destruição dos tecidos do trato GI, a hepatite e a pneumonia são comuns, sendo a pneumonia importante causa de morte em receptores de transplante de medula óssea.
- Infecção por HCMV também está associada à sobrevida reduzida de enxertos de tecidos sólidos. A co-infecção por HCMV de pacientes com infecção por HIV ocorre com muita frequência, proveniente da reativação do vírus latente, e com o declínio das contagens de linfócitos CD4+ e a imunocompetência. Problemas relacionados: pneumonia, cegueira, demência, esofagite, enterocolite, gastrite.
- Latência e reativação: latência provavelmente é estabelecida nos monócitos e macrófagos, e outros tipos de células, como as do rim.

Sintomas da infecção recorrente por CMV. Fonte: http://www.healthcentral.com/breast-cancer/h/cytomegalovirus-recurrence.html
Diagnóstico laboratorial[]
- Marca característica da infecção por CMV é a célula citomegálica, que consiste em uma célula aumentada contendo um “olho de coruja” central basofílico, o qual é um corpo de inclusão intranuclear. As inclusões são facilmente vistas à coloração de Papanicolau ou hematoxilina-eosina.
- Diagnóstico sorológico com técnicas de ELISA pode distinguir a infecção primária da recorrente ao demonstrar a soroconversão da IgG ou a presença de IgM específica para o HCMV. Uso de antígenos purificados de HCMV, produzidos por métodos de DNA recombinante, melhorou a confiabilidade tanto das determinações de IgG como das de IgM.
- Determinação direta da presença e quantidade de DNA ou proteínas virais nos leucócitos é útil como indicador de doença invasivas.
- Vírus extracelulares na urina ou saliva podem simplesmente ser o resultado de um recidiva assintomática.
Tratamento[]
- Aciclovir é inefetivo, pois o HCMV não possui sua própria timidina quinase.
- Dois inibidores da DNA polimerase do HCMV estão disponíveis: ganciclovir, um análogo da guanina que é fosforilado por uma proteína quinase codificada pelo vírus e indicado para infecções invasivas de receptores de transplante e paciente com AIDS, mas tem toxicidade considerável, e o cidofovir, um análogo da deoxicitidina.
- Um terceiro inibidor da DNA polimerase é o ácido fosfonofórmio (foscarnet).

Prevenção e controle[]
- Não há vacina disponível para imunização ativa.
- Uso de preservativos ou a abstinência limitariam a disseminação viral
- Triagem de doadores de sangue ou órgãos para soronegatividade para CMV
Herpesvírus humano tipo 6 e 7[]
Possuem semelhanças com as características biológicas e genômicas do HCMV. Tanto HHV-6 como HHV-7 são agentes causais da roséola infantil (exantema súbito), embora a infecção com HHV-7 seja assintomática.
Patogênese e imunidade[]
O HHV-6 infecta linfócitos, monócitos e células epiteliais e endoteliais, e estabelece infecção latente em células T e monócitos. Replicação nas glândulas salivares é a fonte de vírus secretado na saliva. A infecção por HHV-6 das células linfoides induz a síntese de CD4, interferon α, fator de necrose tumoral α e interleucina 1-β. As células latentes infectadas são encontradas ente a população de linfócitos do sangue periférico.
O HHV-7 é encontrado na saliva, nos linfócitos do sangue periférico e as células de vários órgãos sólidos, incluindo o sistema nervoso central.
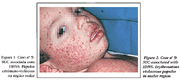
Fonte: http://www.scielo.br/scielo.php?pid=S0365-05962004000600006&script=sci_arttext
Epidemiologia []
A maioria das infecções com HHV-6 e HHV-7 ocorre nos três primeiros anos de vida, com uma incidência de anticorpos se aproximando de 90% da população em torna de 3 anos de idade. Transmissão por secreções orais, pois o vírus se replica nas glândulas salivares e é secretado na saliva.
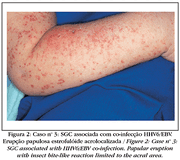
Fonte: http://www.scielo.br/scielo.php?pid=S0365-05962004000600006&script=sci_arttext
Significado clínico[]
- Infecções primárias: roséola infantil sintomática (exantema súbito) é caracterizada por febre alta de 3 a 5 dias, depois surge uma erupção macular eritematosa característica no pescoço e no tronco, melhorando sem sequelas. A infecção primária é a causa mais comum de doenças febris agudas e convulsões febris na ausência da erupção característica. Infecção por HHv-7 produz sintomas idênticos.
- Infecções recorrentes: após imunossupressão por transplante de órgão ou imunocomprometidos relacionado à infecção pelo HIV, a reativação da infecção latente por HHV-6, junto com HCMV, foi associada a pneumonite intersticial, febre, hepatite e encefalite, bem como rejeição de transplante. O HHV-6 acelera a progressão do estagio inicial da infecção pelo HIV à AIDS terminal. A síndrome clinica mais comum em pacientes com AIDS relacionado ao HHV-6 é a encefalite.
Identificação laboratorial[]
Não há um teste diagnóstico simples para infecção primária com HHV-6 ou HHV-7. Amplificação por PCR é usada para demonstrar DNA de HHV-6 no líquido cerebroespinal de paciente com doença neurológica e no soro de paciente com reativação de infecção latente após transplante.
Tratamento e prevenção[]
Devido à relação genética com HCMV, o HHV-6 é inibido pelas mesmas drogas. Em pacientes com AIDS, o tratamento da infecção por HIV parece reduzir também a quantidade de HHV-6. Não há vacina disponível.
Referências bibliográficas[]
MURRAY, Patrick R.; ROSENTHAL, Ken S.; PFALLER, Michael A. . Microbiologia médica. 5. ed. Rio de Janeiro: Elsevier; 2006 979 p.
CHAMPE, Pamela C.; FISHER, Bruce D.; HARVEY, Richard A. Microbiologia ilustrada. 2. ed. São Paulo: Artmed;2008 448 p.
MIURA, Thais Y. Anotações da aula da disciplina Microbiologia e Parasitologia. UNIVILLE. 04/10/13.
Links externos[]
Imagens das viroses em cartões (em inglês)


